Faz pouco tempo aconteceu a ducentésima quadragésima terceira reunião da Sociedade Americana de Química (este ano teremos a trigésima quinta reunião da Sociedade Brasileira de Química, mas a gente chega lá!!!!). Neste encontro, o pesquisador Joe Vinson, que é químico analítico, alegou que encontrou mais polifenóis na pipoca que no vinho tinto, uma tradicional fonte de polifenóis e a principal desculpa dos pinguços para beber vinho todo dia e dizer que faz isso pela saúde... O trabalho do Joe Vinson não foi só medir a quantidade de polifenóis na pipoca, mas sim desenvolver um processo para medir, com precisão, a quantidade de polifenóis em uma amostra heterogênea como a pipoca. Segundo o Dr. Vilson, o problema da pipoca seriam a manteiga, o sal (ou açúcar) e o óleo, ou seja, tudo que diferencia a pipoca de um isopor...
Polifenóis, como o nome indica, são estruturas que possuem alguns fenóis, que são grupos químicos que têm uma hidroxila (OH) ligada a um anel aromático (aquele hexágono com bolinha ou ligações duplas alternadas dentro, ver próximo parágrafo). Abaixo estão alguns exemplos que peguei pela Internet.
Os polifenóis funcionam graças a uma propriedade do anel aromático: a ressonância. Simplificando, ressonância é uma propriedade do anel que faz com que alguns de seus elétrons sejam compartilhados por todos os seus carbonos. Na figura abaixo, na parte de cima, estão representadas as ligações duplas mudando de lugar. É por causa desta "migração" das ligações duplas, que começaram a representar o anel aromático com uma bola no meio de um hexágono, como na parte de baixo da próxima figura. Esta bola representa as ligações que mudam de lugar.
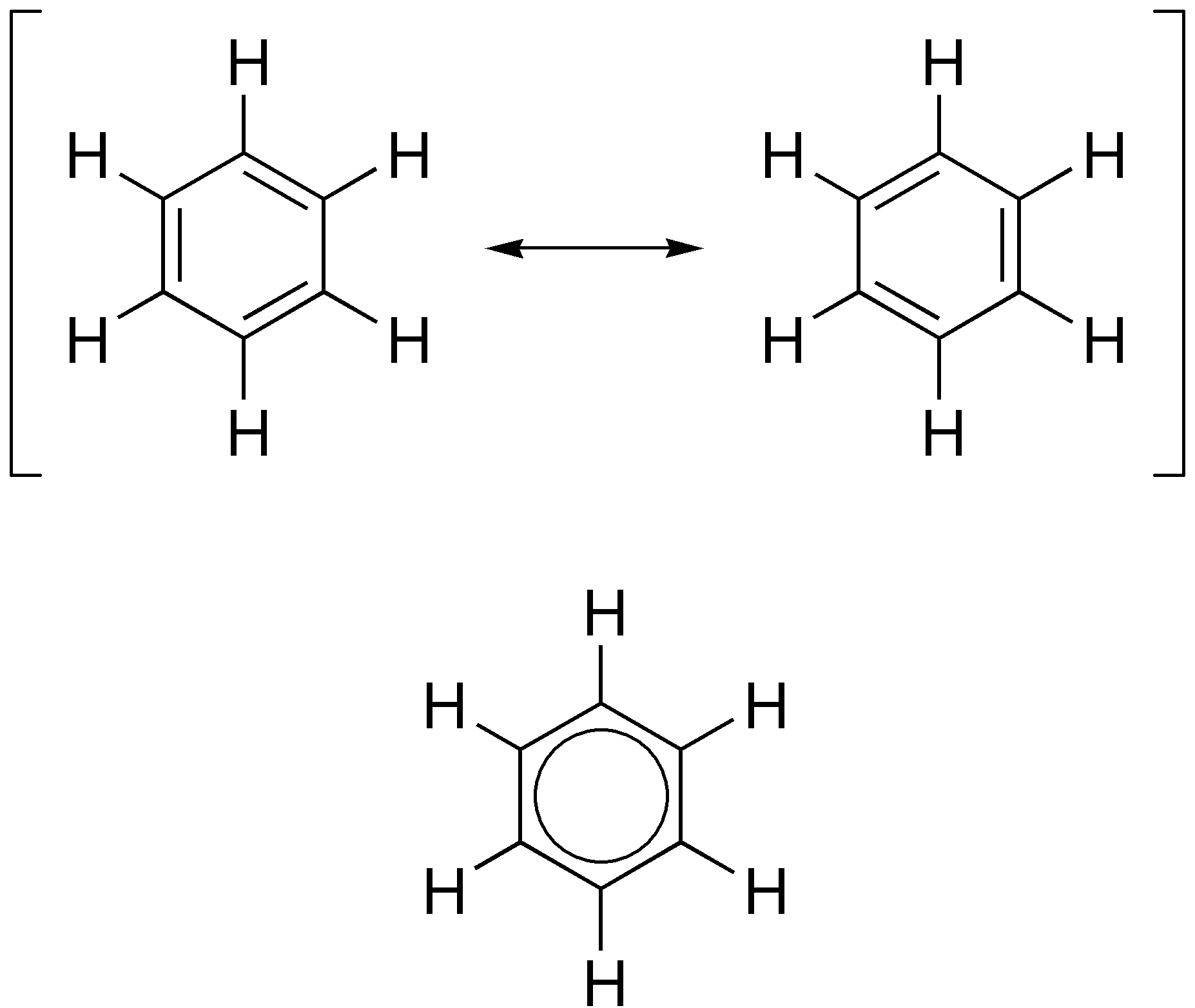 |
O polifenol tem uma propriedade interessante: ele pode reagir com radicais livres no nosso corpo, desativando estes radicais e, ao mesmo tempo, fazendo de si mesmo um radical livre, mas muuuuuito menos reativo, por causa da ressonância. Essa mesma estratégia dos polifenóis no nosso corpo, a gente usa para preservar os polímeros com aditivos chamados de antioxidantes fenólicos, que estabilizam os radicais que estragam os plásticos. A química é versátil, não? :) (Uma explicação simplesinha, com um esquema bonitinho da ação de um antioxidante fenólico, mas em inglês, você pode encontrar nesse link aqui).
A conferência do Dr. Joe Vinson para a imprensa está aqui
(o garoto ao lado, com cara de alegre, foi o aluno do Dr. Vilson que fez
o trabalho). Esse pesquisador gosta de estudar alimentos e tem trabalhos com chocolate, café e outras coisas gostosas!
Para vestibulandos e estudantes: Uma ligação covalente ocorre quando dois átomos compartilham elétrons da última camada. No ensino médio, a gente costuma discutir a quebra heterogênea de ligações, quando falamos de ácidos, para explicar, por exemplo, a ionização do ácido clorídrico (HCl) formando um H+ e um Cl-. Neste caso, os dois elétrons da ligação H-Cl ficam com o cloro enquanto o hidrogênio fica sem nenhum dos elétrons da ligação covalente. Há outro tipo de quebra de ligação, a quebra homogênea, onde cada um dos átomos fica com um dos elétrons da ligação covalente. Neste caso, os dois átomos, com apenas um dos elétrons da ligação covalente, fica com apenas sete elétrons e são chamados de radicais livres. E é justamente por terem sete elétrons que são muito reativos, já que a maioria dos elementos se estabiliza com oito elétrons na última camada.
Parabéns pelo excelente Blog! Já recomendei aos meus alunos e a mim mesmo, rs. Marquei aqui nos favoritos.
ResponderExcluirpodemos abrir um diálogo no youtube 😉
ResponderExcluir